2023年12月8日,FDA批准了首款CRISPR基因编辑疗法CASGEVY™,用于镰刀型贫血症治疗。这标志着基因编辑治疗时代或已开启,未来前景值得期待。
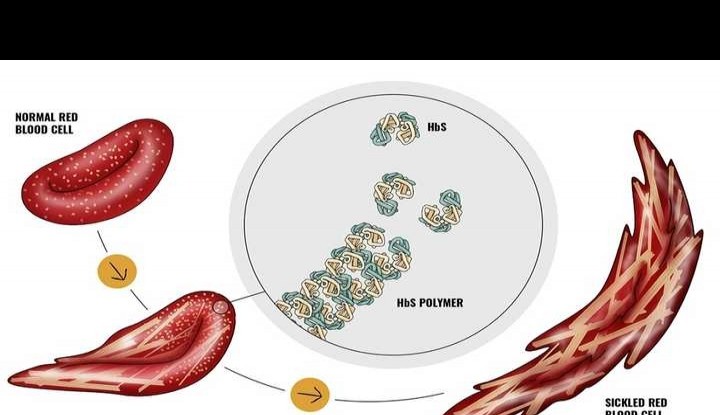
镰状细胞贫血是一种由单基因隐性遗传导致的疾病,其突变发生在成人血红蛋白(HbA)的β亚基上,具体表现为第6位的谷氨酸被缬氨酸取代。这种变异产生的血红蛋白(HbS)不仅携氧能力下降,还会在脱氧状态下聚集成纤维,使红细胞变成僵硬的镰刀形状。变形后的细胞容易破裂,并可能聚集形成栓塞,导致血管阻塞,从而引发患者疲劳、疼痛及器官损伤等症状。以往,骨髓移植是唯一的治疗方法,但仅有不到20%的患者能找到合适的配型。
患者在低氧环境下,突变的血红蛋白(HbS)会聚集成HbS长链,导致红细胞呈现镰刀状变形。而在高氧条件下,HbS能够均匀分布于红细胞中,不会产生聚集现象,从而使红细胞保持正常的形态与功能。因此,提升血液中的氧气浓度,可能成为治疗镰刀型贫血症的有效方法之一。
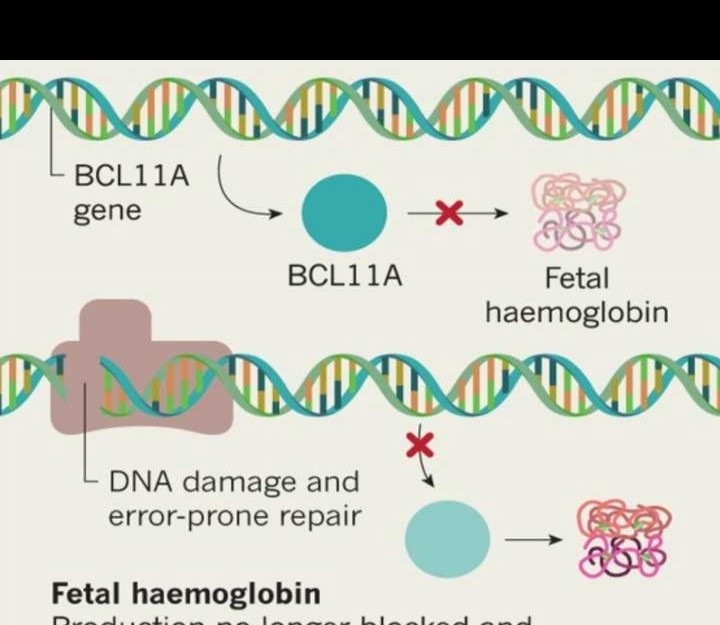
人体内存在两种血红蛋白,分别是成人血红蛋白(HbA)和胎儿血红蛋白(HbF)。HbF主要在胎儿期表达,其携氧能力更强,可高效从胎盘获取氧气。然而,出生后,转录抑制因子BCL11A会抑制γ亚基的表达,导致HbF的合成能力逐渐减弱并被HbA取代。

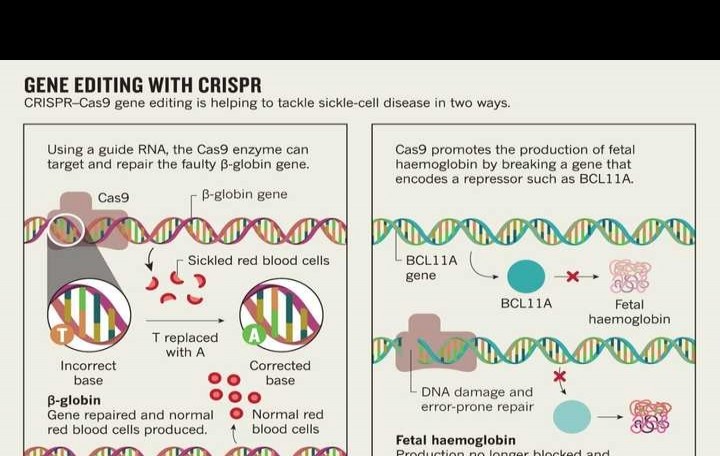
CASGEVY™运用CRISPR基因编辑技术,对患者造血干细胞进行体外改造,使转录抑制因子BCL11A失活,进而促进血红蛋白γ亚基表达。随后,将改造后的干细胞回输至患者体内。持续生成的胎儿血红蛋白(HbF)可提升血液携氧能力,有效缓解因缺氧导致的红细胞镰状变形与坏死问题。
CRISPR基因编辑技术为治愈基因疾病带来了希望,但现实并没有那么简单。人类作为多细胞生物,体内海量细胞各自携带完整的人类基因组。要治愈大多数基因疾病,通常需要对患者大部分细胞进行基因编辑,这本身极具挑战性。例如,在由基因突变引发的癌症治疗中,哪怕仅1%的癌细胞逃过编辑而存活,也会导致前功尽弃。因此,基因编辑在实际应用中面临诸多技术和疗效上的难题。
理论上,治愈镰状细胞贫血只需利用CRISPR技术将突变基因修复为正常序列。然而,要提取患者体内全部造血干细胞并进行基因编辑极为困难。CASGEVY™采用了一种间接方法,通过编辑部分造血干细胞基因,促使其生成胎儿血红蛋白(HbF),从而提升血液携氧能力,让血细胞保持正常形态与功能。因此,基因治疗对那些只需少量细胞恢复基因功能即可显著改善病情的疾病效果明显。这种方法为治疗类似遗传性疾病提供了新思路。
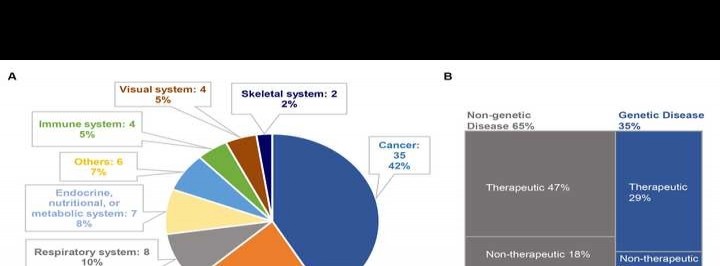
从治疗领域看,CRISPR疗法的应用已从遗传相关疾病(35%)拓宽至非遗传相关疾病(65%)。在84项临床试验中,其主要涵盖癌症(42%)、造血系统疾病(21%)、呼吸系统疾病(10%)、内分泌及代谢疾病(8%)、免疫系统疾病(5%)、眼部疾病(5%)、骨骼疾病(2%)以及其他类型。这表明CRISPR技术正向更多疾病领域拓展。
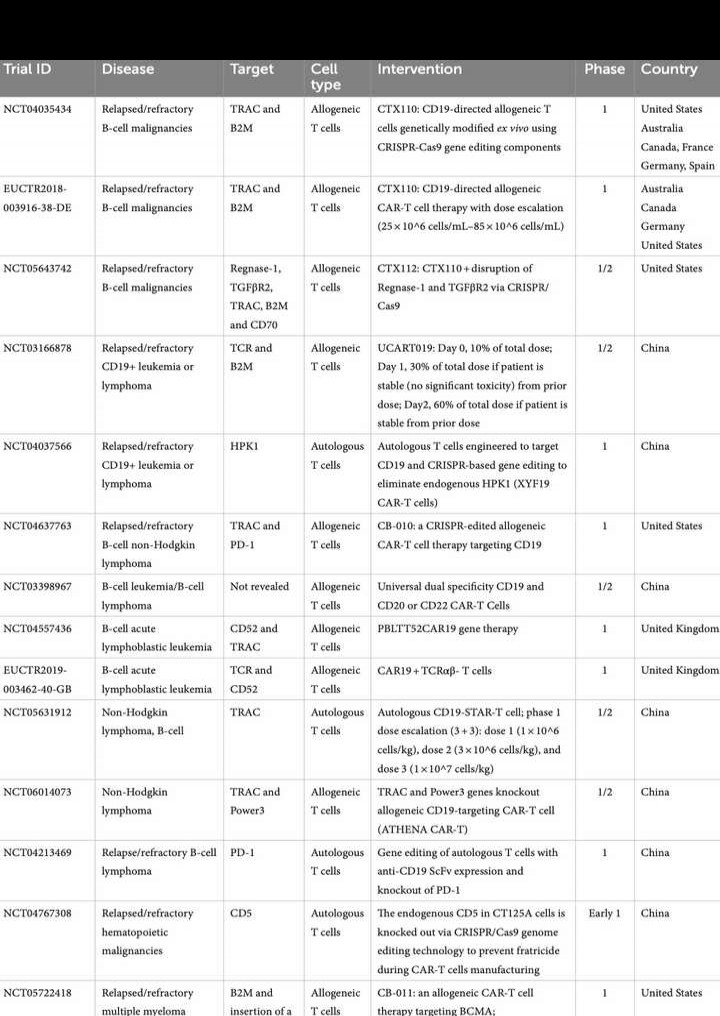
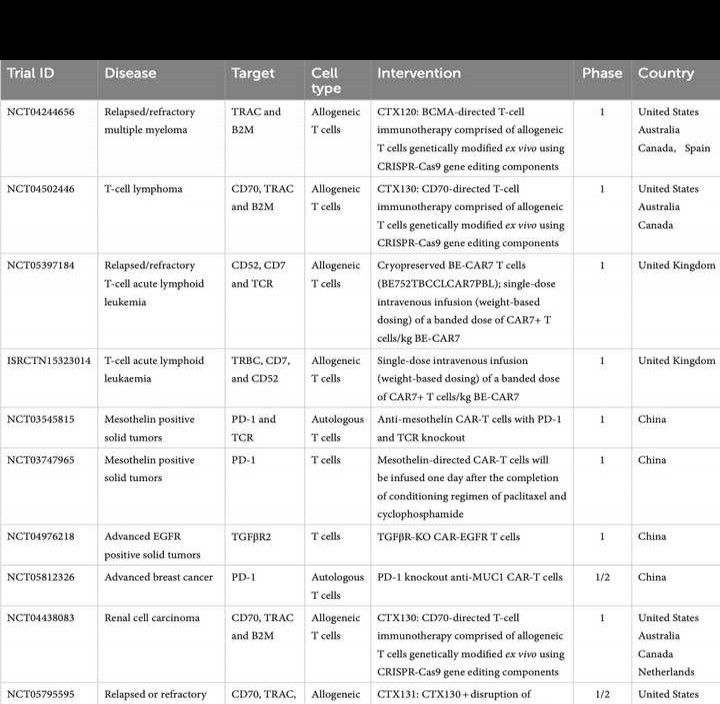
CRISPR技术能够快速完成T细胞的体外改造,推动了CAR-T疗法的进步。其主要靶点涵盖PD-1、TRAC、TCR、CD5、CD52、CD70、TGFβR2、TRBC、B2M、Regnase-1、HPK1、BCMA等,还包括EUCTR和ISRCTN相关研究中的新靶点,为免疫治疗开辟更多可能性。
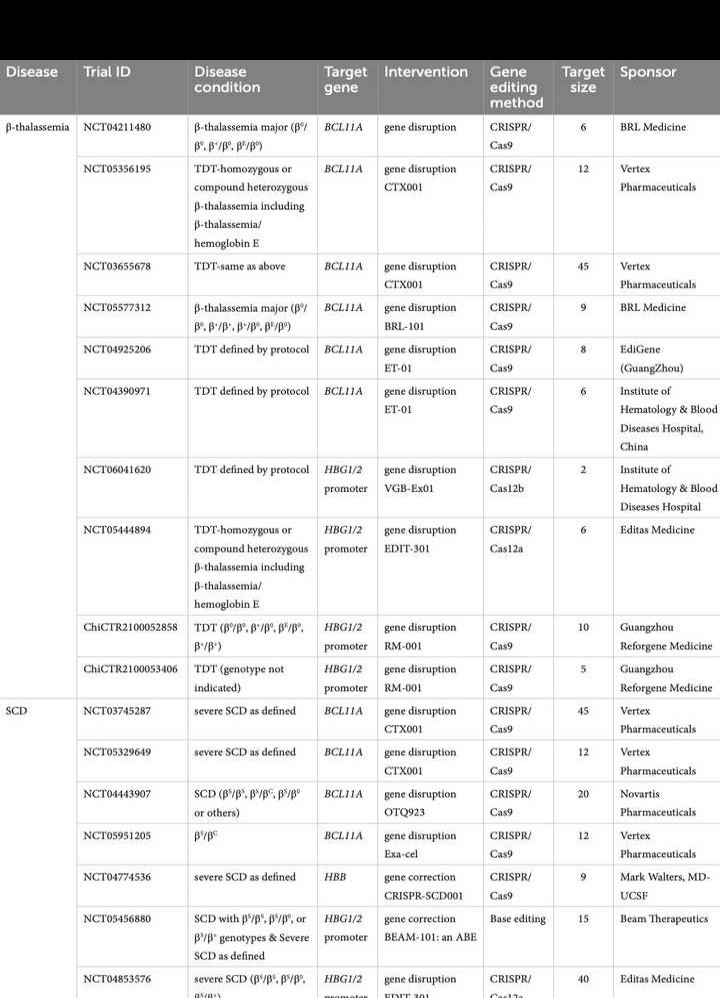
主要靶点包括:BCL11A、HBB以及HBG1/2基因。
I型糖尿病相关靶点包括:HLAs、PD-L1以及CXCL10等分子。
ATTR淀粉样变性心肌病的靶点是TTR。
杂合子家族性高胆固醇血症的靶点是PCSK9。